一般の方へ(附属病院)
一般の方へ(附属病院)
1.治験とは
私達が病気やケガをした時に薬(医療機器等)を使って治療することができます。
近年色々な薬(医療機器等)が誕生しています。
沢山の薬(医療機器等)が既にあるのに何故新しい薬が必要なのでしょうか・・・。
より効果的な薬や、いまだに治療薬が無い病気に対する新しい薬の誕生が期待され、
現在も世界中で様々な研究が行われています。
薬は長い年月と様々な研究を経て誕生しています。
この研究の過程において、多くの人々の協力を得て薬の効果(有効性)や副作用(安全性)、
体内での働きなどを調べています。
この様にヒトを対象とした、有効性や安全性、体内での働きなどを調査するための研究を
「臨床研究」とよびます。
臨床研究のなかでも、新しい薬や医療機器を国(厚生労働省)から認めてもらうために
行う試験を治験といいます。
2.薬が誕生するまで
| 基礎研究 | 薬となる可能性のある候補物質をさがします | |
|---|---|---|
| 非臨床試験 | ネズミやイヌなどの動物を用いて候補物質の有効性(効果)、安全性(副作用)を研究します | |
| 臨床試験 (治験) |
第Ⅰ相 | 少数の健康な人を対象に、主に安全性や体内での働きについて調べます |
| 第Ⅱ相 | 少数の患者さんを対象に有効で安全な薬の量や飲み方を調べます | |
| 第Ⅲ相 | 多数の患者さんを対象に有効性や安全性について既に発売されている薬や薬効の無い物質(プラセボ)と比較します | |
| 承認審査 | 得られたデータを基に国(厚生労働省)へ申請し、審査されます。認められると薬として販売されます | |
| 製造販売後 臨床試験・調査 |
既に販売された薬について治験中では得られなかった情報や、他の治療方法などを調査します | |
新しい薬を作るためには治験が必要であり、現在私達が使っている薬も過去に多数の人々の協力を得て誕生しました。
次世代の人々のためにも、新しい薬を作るためには皆さまのご理解・ご協力が必要なのです。
3.治験の流れ
1)治験計画の立案と各医療機関への依頼
製薬会社は治験を実施する前に厚生労働省に治験実施計画の届出をします。
厚生労働省は届出された治験実施計画の内容に関して安全性、倫理性の観点から調査を行います。
製薬会社は治験の届出が国に受理された後に、各医療機関へ治験の依頼を開始します。
治験を実施する施設は製薬会社の定めた基準を満たした医療機関が選ばれます。
●当院で実施中の治験に参加する場合は、当院の実施診療科での診察が必要となります。
・ 当院受診中の方へ:まずは主治医へご相談下さい。
・ 他の医療機関受診中の方へ:まずは当院受診の手続きをお願いします。
当院を受診される際は、「かかりつけ医」等からの紹介状をご持参ください。
詳しくは、当院ホームページ[外来受診について ![]() ]をご確認下さい。
]をご確認下さい。
2)院内の臨床試験審査委員会(IRB)での審査
治験や製造販売後臨床試験は国が定めた法律を守って実施しなければなりません。
当院では院内に臨床試験審査委員会(IRB)を設置しており、治験を実施するうえで、「患者さんの安全性や治験の倫理性が守られていること」、「試験の妥当性」などを審議します。
また、実施中の治験については、患者さんの安全性に影響を及ぼす可能性のある新たな情報を入手した場合などに、治験継続の可否について審議します。
IRBの詳細については、[こちら ![]() ]のページをご覧下さい。
]のページをご覧下さい。
主に治験等の実施の可否を審査する臨床試験審査委員会の運営を担当しています。
その他に、臨床研究の契約調整や製造販売後調査(使用成績調査など)の事務手続きなどを行っています。
4.当院で実施中の治験
当院で実施中の治験は[こちら ![]() ]をご確認下さい。
]をご確認下さい。
5.連絡先
公立大学法人 横浜市立大学附属病院 臨床試験管理室
〒 236-0004 神奈川県横浜市金沢区福浦3-9
TEL: 045-787-2800(代表) 内線:3079
TEL: 045-787-2714(直通) FAX:045-787-2632
対応時間は9:00~17:00となっております。
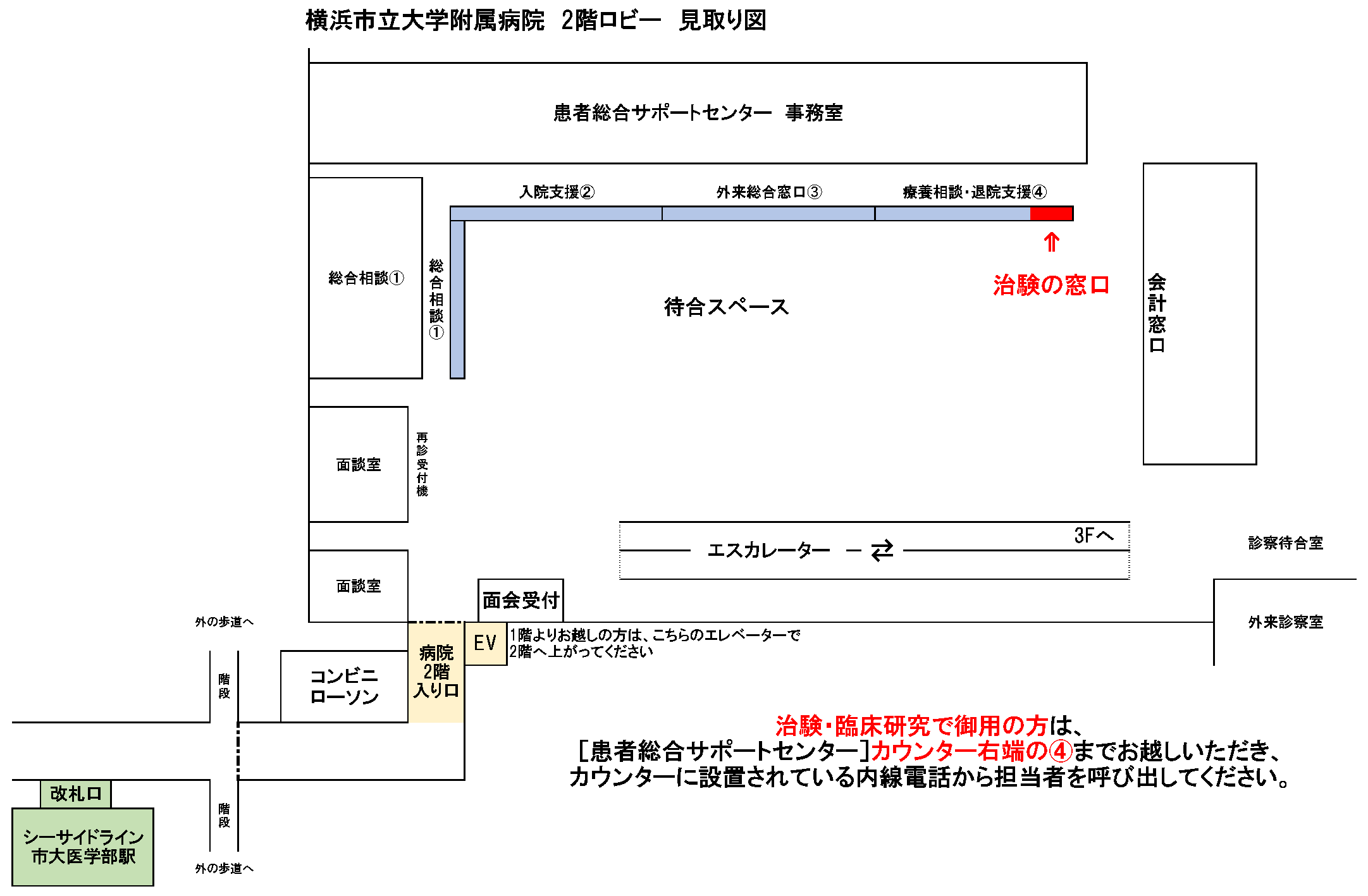
院内マップ
ynext